Menentukan Orbital Elektron Valensi Serta Jumlah Elektronnya
Tentukan elektron Valensi dari atom-atom berikut ini
a. B (Z= 5)
b. Ca (Z=20)
c. Mn (Z=25)
d. Ag (Z=47)
Elektron valensi adalah elektron yang biasa di pergunakan atom untuk membentuk ikatan kimia. Untuk unsur golongan utama maka elektron valensi terletak pada orbital ns atau ns np sedangkan untuk golongan transisi maka elektron valensi terletak pada orbital (n-1)d ns.
a. Untuk B dengan nomor atom 5 maka konfigurasi elektronnya adalah sebagai berikut,
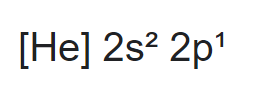
B terletak pada golongan utama dan jika dilihat dari konfigurasi diatas maka elektron valensi boron terletak pada orbital 2s2 2p1 maka jumlah elektron valensinya ada 3 elektron (2 elektron dari orbital s dan 1 elektron dari orbital p)
b. Konfigurasi elektron untuk atom Ca adalah sebagai berikut,

Dapat dilihat dari konfigurasi elektron diatas maka elektron valensi untuk atom Ca terletak pada orbital 4s2 dimana jumlah elektronya adalah 2.
c. Untuk unsur Mangan (Mn) maka konfigurasi elektron dapat ditulis sebagai berikut,

Mn adalah golongan transisi, menurut rumus diatas maka elektron valensi golongan transisi terletak pada orbital (n-1)d ns, maka elektron valensi mangan terletak pada orbital 4s2 3d5 dimana elektron valensinya totalnya adalah 7. Hal ini adalah benar mengingat Mn dapat membentuk ion dari Mn2+ sampai dengan Mn7+
d. Konfigurasi perak Ag dengan nomor atom 47 adalah sebagai berikut,
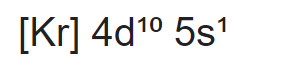
Kita lihat bahwa orbital 4d memiliki 10 elektron atau orbitalnya penuh dengan elektron, orbital d yang memiliki 10 elektron adalah orbital yang stabil (ingat aturan penuh dan setengah penuh). Maka akibatnya Ag hanya memiliki elektron valensi di orbital 5s1, dan hal ini sesuai dengan atom Ag yang umumnya membentuk ion Ag+