Sifat Koligatif Larutan : Teori & Definisi
Sifat koligatif larutan adalah sifat larutan yang hanya dipengaruhi atau ditentukan dari banyaknya jumlah zat yang terdapat di dalam larutan tersebut. Sifat koligatif larutan dibedakan atas empat macam yaitu,
- Penurunan tekanan uap
- Kenaikan titik didih larutan
- Penurunan titik beku larutan
- Tekanan osmotik
Karena sifat koligatif hanya ditentukan oleh seberapa banyak jumlah zat dalam larutan maka kita dapat mengatakan bahwa 0,1 molal larutan urea dalam air akan memiliki kenaikan titik didih atau penurunan titik beku yang sama dengan larutan 0,1 mol glukosa.
atau kita dapat mengatakan bahwa 1 Molar larutan CaCl2 akan memiliki tekananosmotik yang sama dengan larutan 1 Molar BaCl2. Contoh yang lain adalah 0,25 fraksimol larutan sukrsa akan memiliki penurunan tekanan uap yang sama dengan larutan 0,25 fraksimol fruktosa.
Bagaimana hal ini dapat dijelaskan ? sesuai dengan definisi sifat koligatif maka kita tidak memandang jenis senyawa yang terlarut dalam suatu larutan akan tetapi sifat koligatif hanya ditentukan oleh seberapa banyak jumlah zat atau partikel yang terdapat dalam larutan tersebut. Sekarang kita bahas yok satu persatu dari empat macam sifat koligatif larutan.
- Penurunan Tekanan Uap Larutan
Jika kita punya air di dalam piring dan kita biarkan di udara terbuka maka lama kelamaan air didalam piring tersebut akan menguap. Penguapan adalah proses berubahnya suatu zat cair yang berwujud cair menjadi bentuk gas. Banyaknya uap air diatas permukaan cairan diukur berdasarkan tekanan uap cairannya. Jika uap air yang terdapat di atas permukaan air semakin banyak maka tekanan uapnya akan semakin tinggi dan sebaliknya.
Berikut contoh tekanan uap air muri dengan tekanan uap larutan (dengan zat terlarut yang sifatnya tidak mudah menguap contohnya glukosa, urea, sukrosa, dll). Bola berwarna biru adalah molekul air sedangan bola berwarna merah adalah zat terlarut.
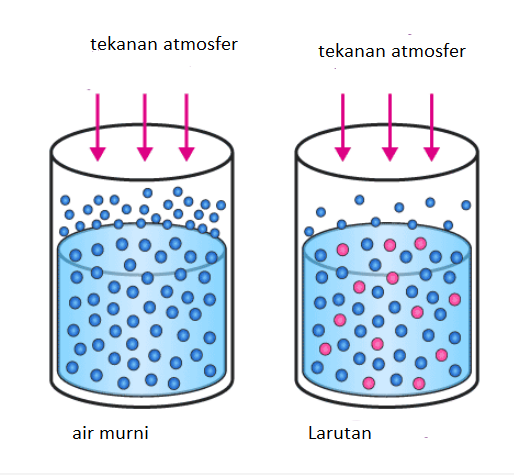
Dapat kita perhatikan dari gambar diatas bahwa air murni memiliki uap air (sebelah kiri) yang lebih banyak dibandingkan dengan larutan (sebelah kanan). Kenapa hal ini bisa terjadi ?
Pertama yang perlu diingat adalah zat terlarut yang ada di dalam larutan adalah zat yang tidak mudah menguap oleh karena itu yang menguap di dari dua wadah diatas hanya air saja. Kita bandingkan yuk permukaan dari kedua wadah diatas. Kenapa yang diperhatikan adalah permukaannya saja? Disebabkan molekul air yang mudah terlepas untuk menguap adalah molekul air yang ada dipermukaan.
Permukaan air murni hanya terdapat molekul air saja, akan tetapi permukaan larutan selain terdapat molekul air juga terdapat molekul zat terlarut. Artinya dalam larutan sebagian molekul air yang ada di permukaan digantikan oleh molekul zat terlarut. Dengan kata kata lain molekul air di permukaan air murni lebih banyak dibandinghkan dengan jumlah molekul air dipermukaan lartan.
Akibatnya tentu saja saat menguap wadah air murni memiliki uap air yang lebih banyak dibandingkan dengan uap air yang ada di atas permukaan larutan. Hal inilah yang menyebabkan tekanan uap larutan menjadi lebih kecil dibandingkan dengan tekanan uap air murninya, dan peristiwa ini disebut sebagai ‘penurunan tekanan uap larutan’
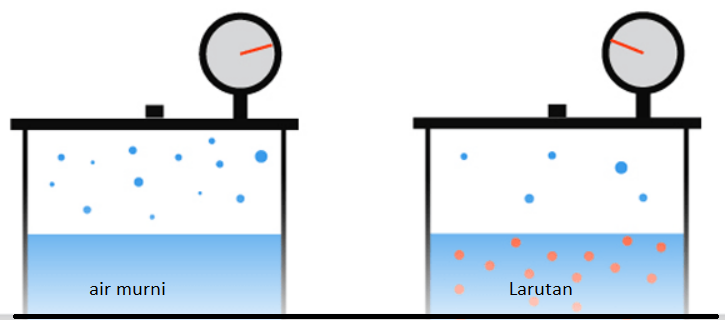
Tekanan uap larutan selalu lebih rendah dari tekanan uap pelarut murninya. Penurunan tekanan uap larutan ini berbanding lurus dengan fraksi mol larutan dimana dikenal dengan nama hukum Raoult.

Dengan P adalah tekanan uap larutan, Po adalah tekanan uap pelarut murni dan delta P adalah penurunan tekanan uap larutan.
2. Kenaikan Titik Didih Larutan
Titik didih adalah temperatur dimana tekanan uap diatas permukaan zat cair sama dengan tekanan udara luar. Titik didih air murni pada tekanan 1 atm adalah 100 derajat celcius. Akan tetapi jika kedalam air tersebut kita tambahkan zat yang tidak mudah menguap maka titik didih larutan tersebut akan melebihi titik didih pelarut murninya.
Pada larutan tersebut akan terdapat dua komponen yaitu pelarut murni dan zat terlarut yang tidak mudah menguap. Nah kehadiran zat yang terlarut yang tidak mudah menguap ini menjadikan larutan memiliki tekanan uap yang lebih rendah dibandingkan dengan pelarut murninya, ha inilah yang menyebabkan diperlukan energi yang lebih tinggi untuk membuat larutan mendidih.
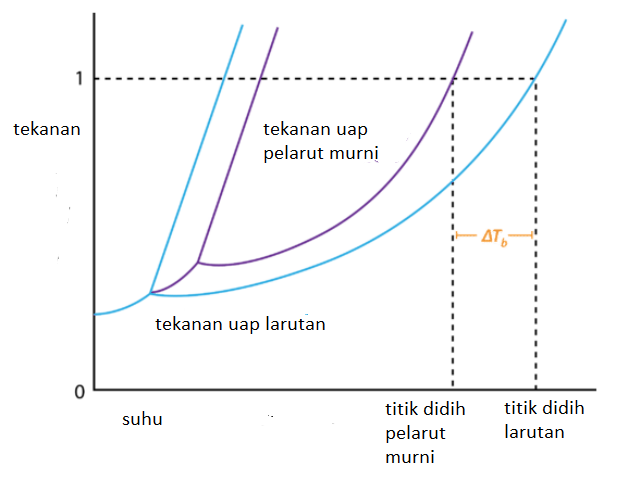
Kenaikan titik didih larutan merupkan selisih antara temperatur titik didih larutan dengan titik didih pelarut murninya. Kenaikan titik didih larutan sebanding dengan molalitas larutan dan dirumuskan dengan formula sebagai berikut,
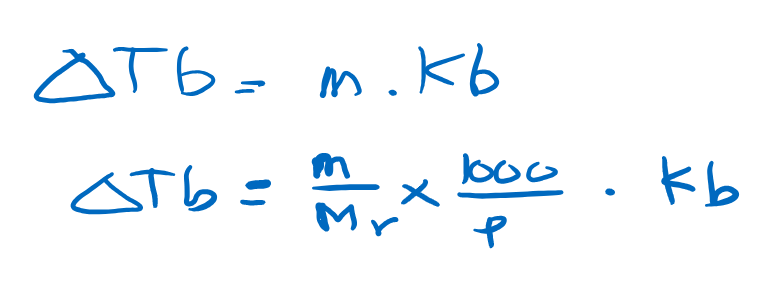
dimana :
delta TB = kenaikan titik didih larutan
m = massa zat terlarut
Mr = massa molekular zat terlarut
P = massa pelarut
Kb = tetapan kenaikan titik didih molal
Tetapan kenaikan ttik didih molal (Kb) disebut juga dengan naa konstanta ebulioskopik dan memiliki satuan oC/molal atau oC.Kg/mol. Untuk pelarut air maka nikai Kb adalah 0.52 oC/m.
3. Penurunan Titik Beku Larutan
Seperti halnya kenaikan titik didih larutan, maka penurunan titik beku larutan juga merupakan sifat koligatif larutan. Dimanasfat ini tidak dipengaruhi oleh jenis zat yang terlarut didalam larutan akan tetapi ditentukan oleh banyaknya jumlah zat yang terlarut didalam larutan.
Air murni mendidih pada suhu 0 oC pada tekanan 1 atm, namun jika kita menambahkan zat terlarut yang tidak mudah menguap maka titik beku larutan akan lebih rendah dari titik didih pelarutnya (air murni0 itu sendiri. Contohnya air laut akan membeku pada suhu dibawah 0 oC disebabkan kehadiran garam didalam air laut tersebut.
Membeku adalah proses dimana molekul-molekul zat cair saling mendekat dan merapat sehingga akan terjadi gaya tark-menarik yang kuat antara molekul sehingga terbentuk zat padat. Kehadiran zat terlarut akan menyebabkan molekul-molekul zat cair susah untuk saling merapat disebabkan terdapat halangan dari molekul zat terlarut, hal ini menyebabkan diperlukan suhu yang lebih rendah agar terjadi proses pembekuan. Oleh sebab itu kehadiran zat terlarut akan menurunkan titik belu larutan.
Penurunan titik beku larutan sebanding dengan kemolalan za terlarut dan dirumuskan dengan rumus sebagai berikut,

dimana,
delta Tf = penurunan titik beku larutan
m = massa zat terlart
Mr = Mr zat terlarut
P = massa pelarut
Kf = tetapan penurunan titik beku molal
Tetapan penurunan titik beku molal atau Kf disebut juga dengan konstanta krioskopik ddan memiliki satuan oC/m . Untuk pelarut air mak harga Kf adalah sama dengan 1.86 oC/m
4. Tekanan Osmotik
Osmosis adalah peristiwa bergeraknya molekul zat pelarut atau larutan encer melalui membran semipermiabel ke dalam larutan yang lebih pekat. Perhatikan gambar A, terdapat pipa U yang dibagian tengahnya di pisahkan dengan membran semiperrmiabel. Pipa sebelah kiri diisi air murni dan sebelah kanan diisi larutan glukosa.
Setelah dibiarkan beberapa saat maka molekul air akan bergerak melalui membran semipermiabel hingga mencapai kesetimbangan. Setelah terjadi kesetimbangan maka permukaan pipa sebelah kanan yang berisi larutan glukosaakan menjadi lebih tinggi setinggi ‘h’ (gambar b). Nah jika kita mengaplikasikan tekanan di sisi kanan pipa U (gambar c) hingga tinggi permukan airan dikedua sisi pipa U kembali sama maka kita menyebut tekanan ini dengan sebutan ‘tekanan osmotik‘.
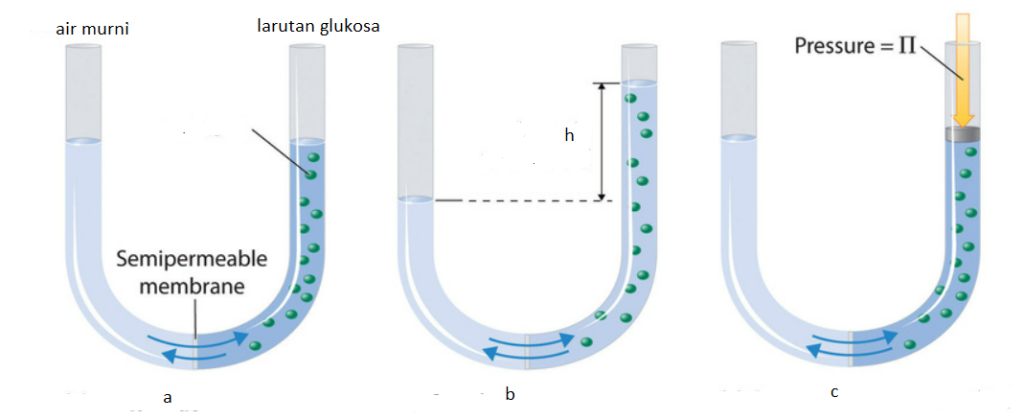
Tekanan osmotik sebanting dengan molartas larutan sehingga dirumuskan dengan rumus sebagai berikut,
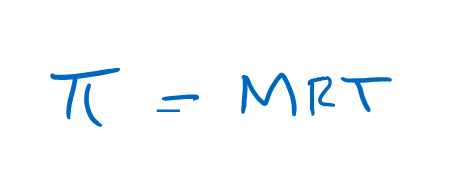
dimana,
phi = tekanan osmotik (atm)
M = molaritas larutan (Mol/liter)
R= tetapan gas ideal 0,082 L.Atm/mol.K
T= Suhu mutlak (Kelvin)
Sifat Koligatif Larutan Elektrolit
Seperti yang kita ketahui bahwa sifat koligatif ditentukan oleh banyaknya partikel yang terdapat didalam larutan dan bukan jenis zat yang dilarutkan dalam larutan. Oleh sebab itu terjadi perbedaan jika kita melarutkan zat non elektrolit dengan zat elektrolit disebabkan zat elektrolit akan menghasilkan ion positif dan negatif.
Jika kita melarutkan glukosa (nonelektrolit) maka molekul glukosa aka tetap berada dalam bentuk sau molekul glukosa, namun jika kita melarutkan NaCl maka akan dhasilka ion Na+ dan Cl- jadi terdapat dua partikel didalam larutan NaCl. Begitu juga dengan melarutkan CaCl2 dimana aan dihasilkan tiga partikel yakni satu dari Ca2+ dan dua dari 2Cl-.
Oleh sebab itu untuk menghitung sifat koligatif larutan elektrolit maka kita perlu meambah apa yang disebut dengan vaktor Van’t Hoff yaitu,
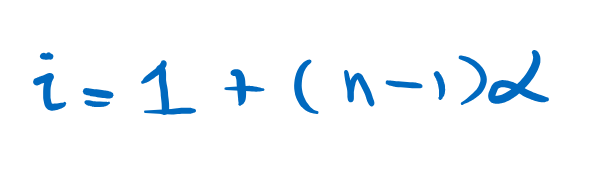
dimana
i = vaktor van’t Hoff
n = jumlah ion yang dihasilkan dari elektrolit (NaCl= 2 CaCl2 = 3)
alfa = derajat ionisasi (untuk elektrolit kuat = 1
