Hubungan Teori Asam-Basa Arrhenius, Bronsted-Lowry, dan Lewis
Hubungan antara teori asam basa Arrhenius, Bronsted-Lowry, dan Lewis dapat kita gambarkan dalam bentuk diagram seperti berikut,
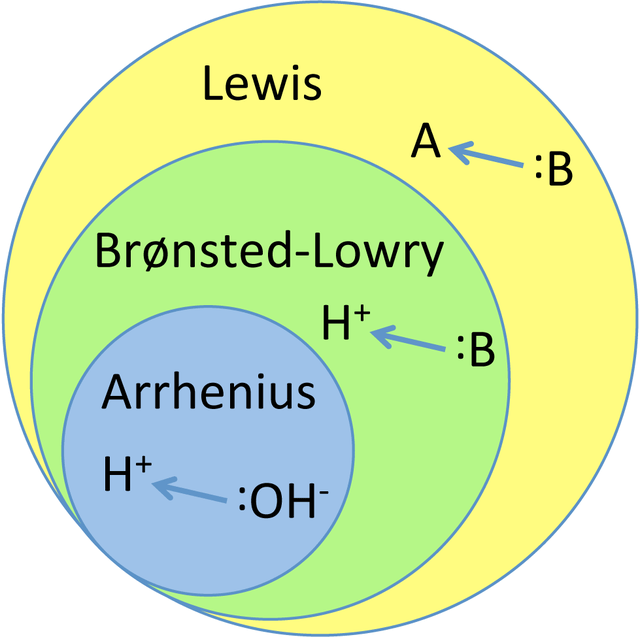
Teori asam-basa Arrhenius adalah teori asam basa yang sangat spesifik sehingga teori ini masuk kedallam dua teori lainnya yaitu teori asam-basa Bronsted-Lowry, dan Lewis. Yang di maksud spesifik disini adalah teori asam basa Arrhenius menyebutkan bahwa asam adalah spesies yang dapat menghasilkan ion H+ didalam larutan sedangkan basanya adalah spesies yang dapat menghasilkan ion OH- di dalam larutan. Sebagai tambahan teori asam basa Arrhenius hanya dapat dipakai untuk spesies yang laut dalam pelarut air.
Teori asam basa Bronsted-Lowry tidak menentang teori asam basa Arrhenius akan tetapi teori ini malah memperluas cakupan teori asam basa Arrhenius disebabkan teori ini dapat dipakai untuk menentukan asam basa dalam pelarut non air dan air.
Teori asam basa Bronsted-Lowry didasarkan pada konsep transfer proton, hal ini lebih luas dan lebih inklusif dibandingkan dengan teori Arrhenius yang hanya melibatkan spesies yang dapat menghasilkan H+ di dalam air. Teori asam basa Bronsted-Lowry lebih banyak dipergunakan secara luas dalam kimia untuk menjelaskan perilaku asam basa dalam larutan berbasis air.
Terakhir teori asam basa Lewis adalah teori asam basa yang cenderung kurang spesifik, dimana artinya teori ini mengijinkan kita untuk menentukan asam dan basa dalam spektrum yang lebih luas. Asam Lewis adalah aseptor pasangan elektron sedangkan basa Lewis adalah donor pasangan elektron. Teori ini tidak menyebutkan proton ataupun ion hidrogen dimana hal ini memberikan kesempatan untuk menentukan asam atau basa ke jangkauan yang lebih luas.